Un nuovo studio della Fondazione Michelangelo, condotto in collaborazione con il CRUK Cambridge Institute, mostra che nel tumore della mammella triplo-negativo la composizione cellulare dell’ecosistema tumorale, con particolare riferimento alle cellule del sistema immunitario, e la loro distribuzione spaziale influenzano la sensibilità o resistenza all’immunoterapia basata sull’uso di inibitori dei checkpoint immunitari (ICB). I risultati, pubblicati sulla prestigiosa rivista scientifica Nature, potrebbero contribuire all’immuno-oncologia di precisione nel carcinoma mammario e non solo.
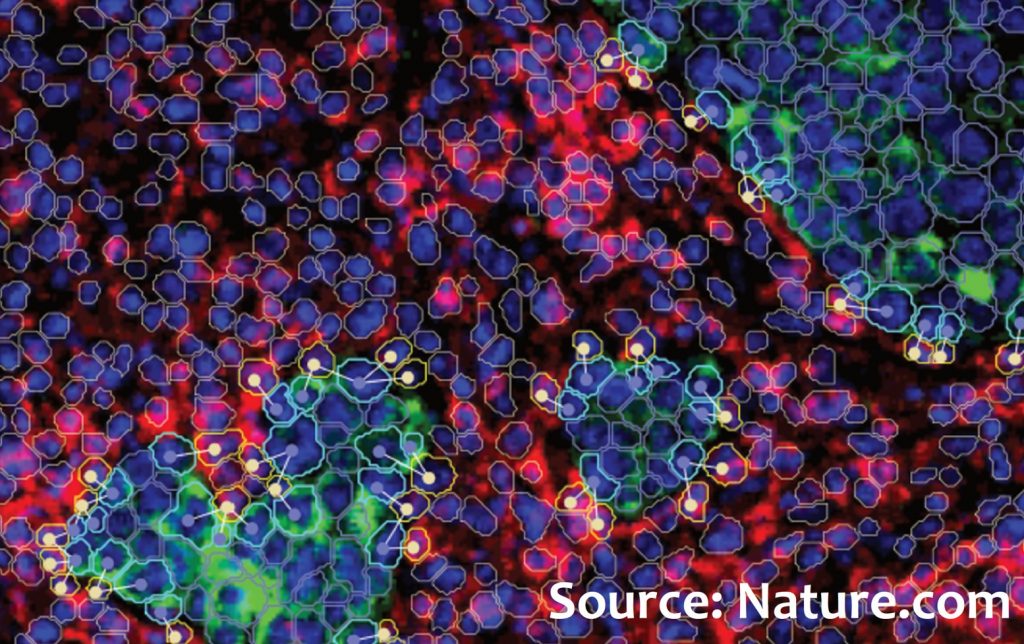
Lo studio ha coinvolto 243 pazienti con carcinoma mammario triplo negativo arruolate nello studio randomizzato NeoTRIP. In questo studio, le pazienti hanno ricevuto chemioterapia neoadiuvante con o senza l’aggiunta dell’inibitore del checkpoint immunitario PD-L1, atezolizumab. Inoltre, sono stati raccolti i campioni di tumore in tre diversi momenti (prima della terapia, n=243; dopo 1 mese dall’inizio della terapia, n=207; dopo la terapia, alla chirurgia, n=210). Per studiare i determinanti della risposta all’immunoterapia, i ricercatori hanno utilizzato una tecnica estremamente sofisticata chiamata Imaging Mass Cytometry che permette di quantificare contemporaneamente l’espressione di 43 proteine chiave con una risoluzione a singola cellula. , i ricercatori hanno utilizzato una tecnica estremamente sofisticata chiamata Imaging Mass Cytometry che permette di quantificare contemporaneamente l’espressione di 43 proteine chiave con una risoluzione a singola cellula. Sulla base dei profili di espressione proteica, sono state identificate 17 popolazioni di cellule tumorali/epiteliali e 20 del microambiente tumorale. Queste popolazioni sono espressione sia del tipo di cellula che del suo stato funzionale.
Una delle osservazioni più importanti è stata che la presenza di cellule tumorali proliferanti che esprimevano MHC-I e II e di cellule T CD8 proliferanti esprimenti TCF1 erano fortemente predittive di un elevata probabilità di eradicazione completa del tumore (risposta patologica completa, pCR), ma soltanto in presenza di immunoterapia. Sfruttando anche le informazioni di distribuzione spaziale delle cellule, sono stati quantificati i contatti stretti e diretti tra cellula e cellula, per ciascuno tipo cellulare. È così emerso che un numero elevato di interazioni strette tra le cellule tumorali e cellule immunitarie quali i linfociti B e i linfociti T CD8 con elevata presenza di granzyme B (cellule citotossiche attivate) erano anch’esse associate ad una elevata probabilità di benefico da immunoterapia. Inoltre, studiando i campioni raccolti durante il trattamento, è emerso che i tumori sensibili destinati ad ottenere una pCR si arricchivano di cellule T CD8 granzyme B+, mentre i tumori resistenti erano caratterizzati da un incremento della presenza di cellule tumorali CD15+, un nuovo possibile meccanismo di resistenza adattiva.
Complessivamente, mappando l’ecosistema tumorale multicellulare in situ, questo studio ha dimostrato che sia il livello di proliferazione di alcune popolazioni cellulari, sia il tipo e quantità di interazioni cellula-cellula predicono la risposta all’immunoterapia nel carcinoma mammario triplo negativo. La risposta è caratterizzata da un afflusso di cellule T citotossiche attivate e la somministrazione di ICB rimodella la struttura del tumore con differenze tra tumori sensibili e resistenti. I risultati di questo studio fondamentale indicano che il fenotipo cellulare, lo stato di attivazione e l’organizzazione spaziale contribuiscono collettivamente all’effetto dell’immunoterapia con atezolizumab. La mappatura sistematica in situ dell’ecosistema tumorale potrebbe offrire un contributo di grande importanza ad una immuno-oncologia di precisione nel carcinoma mammario e potrebbe avere rilevanza anche per altri tipi di tumori.
Un nuovo studio della Fondazione Michelangelo, condotto in collaborazione con il CRUK Cambridge Institute, mostra che nel tumore della mammella triplo-negativo la composizione cellulare dell’ecosistema tumorale, con particolare riferimento alle cellule del sistema immunitario, e la loro distribuzione spaziale influenzano la sensibilità o resistenza all’immunoterapia basata sull’uso di inibitori dei checkpoint immunitari (ICB). I risultati, pubblicati sulla prestigiosa rivista scientifica Nature, potrebbero contribuire all’immuno-oncologia di precisione nel carcinoma mammario e non solo.
Lo studio ha coinvolto 243 pazienti con carcinoma mammario triplo negativo arruolate nello studio randomizzato NeoTRIP. In questo studio, le pazienti hanno ricevuto chemioterapia neoadiuvante con o senza l’aggiunta dell’inibitore del checkpoint immunitario PD-L1, atezolizumab. Inoltre, sono stati raccolti i campioni di tumore in tre diversi momenti (prima della terapia, n=243; dopo 1 mese dall’inizio della terapia, n=207; dopo la terapia, alla chirurgia, n=210). Per studiare i determinanti della risposta all’immunoterapia, i ricercatori hanno utilizzato una tecnica estremamente sofisticata chiamata Imaging Mass Cytometry che permette di quantificare contemporaneamente l’espressione di 43 proteine chiave con una risoluzione a singola cellula. , i ricercatori hanno utilizzato una tecnica estremamente sofisticata chiamata Imaging Mass Cytometry che permette di quantificare contemporaneamente l’espressione di 43 proteine chiave con una risoluzione a singola cellula. Sulla base dei profili di espressione proteica, sono state identificate 17 popolazioni di cellule tumorali/epiteliali e 20 del microambiente tumorale. Queste popolazioni sono espressione sia del tipo di cellula che del suo stato funzionale.
Una delle osservazioni più importanti è stata che la presenza di cellule tumorali proliferanti che esprimevano MHC-I e II e di cellule T CD8 proliferanti esprimenti TCF1 erano fortemente predittive di un elevata probabilità di eradicazione completa del tumore (risposta patologica completa, pCR), ma soltanto in presenza di immunoterapia. Sfruttando anche le informazioni di distribuzione spaziale delle cellule, sono stati quantificati i contatti stretti e diretti tra cellula e cellula, per ciascuno tipo cellulare. È così emerso che un numero elevato di interazioni strette tra le cellule tumorali e cellule immunitarie quali i linfociti B e i linfociti T CD8 con elevata presenza di granzyme B (cellule citotossiche attivate) erano anch’esse associate ad una elevata probabilità di benefico da immunoterapia. Inoltre, studiando i campioni raccolti durante il trattamento, è emerso che i tumori sensibili destinati ad ottenere una pCR si arricchivano di cellule T CD8 granzyme B+, mentre i tumori resistenti erano caratterizzati da un incremento della presenza di cellule tumorali CD15+, un nuovo possibile meccanismo di resistenza adattiva.
Complessivamente, mappando l’ecosistema tumorale multicellulare in situ, questo studio ha dimostrato che sia il livello di proliferazione di alcune popolazioni cellulari, sia il tipo e quantità di interazioni cellula-cellula predicono la risposta all’immunoterapia nel carcinoma mammario triplo negativo. La risposta è caratterizzata da un afflusso di cellule T citotossiche attivate e la somministrazione di ICB rimodella la struttura del tumore con differenze tra tumori sensibili e resistenti. I risultati di questo studio fondamentale indicano che il fenotipo cellulare, lo stato di attivazione e l’organizzazione spaziale contribuiscono collettivamente all’effetto dell’immunoterapia con atezolizumab. La mappatura sistematica in situ dell’ecosistema tumorale potrebbe offrire un contributo di grande importanza ad una immuno-oncologia di precisione nel carcinoma mammario e potrebbe avere rilevanza anche per altri tipi di tumori.